Γράφει ο ιατρός 
Πέτρος Χειρίδης, MD,PhD
Μαιευτήρας-Γυναικολόγος-χειρουργός
Διδάκτωρ του Πανεπιστημίου Αθηνών
Επιστ. Δ/ντης– Νομική Υπηρεσία ομίλου ΙΑΣΩ.
Κρυοσυντήρηση ωαρίων
Ολοένα περισσότερες γυναίκες, ρωτούν αν πρέπει να διαφυλάξουν ωάρια για τη διατήρηση τη γονιμότητας και ποια είναι η σωστή ηλικία φύλαξης. Στο άρθρο που ακολουθεί, απαντάμε με γνώμονα τις επίκαιρες θέσεις της διεθνούς βιβλιογραφίας.
Τι είναι η κρυοσυντήρηση ωαρίων;
Σημαίνει την ανάκτηση ωαρίων με χειρουργική διαδικασία, έπειτα από ορμονική διέγερση της ωοθήκης, και τη διατήρηση των κυττάρων αυτών σε συνθήκες ψύξης. Στόχος είναι, η μετέπειτα απόψυξη, αναζωογόνηση και χρήση των ωαρίων σε τεχνικές υποβοηθούμενης αναπαραγωγής για τη διατήρηση της γονιμότητας.Η κρυοσυντήρηση ωαρίων φέρνει ηθικά διλήμματα αλλά και αντιπαραθέσεις αναφορικά με το αν πρέπει να εφαρμόζεται εκλεκτικά επί ιατρικών ενδείξεων, ή προληπτικά σε υγιείς γυναίκες.
Ποιες οι ενδείξεις για κρυοσυντήρηση ωαρίων;
Η ιδέα της διατήρησης της γονιμότητας μέσω της κρυοσυντήρησης κυττάρων δεν είναι καινούρια. Ήδη από τη δεκαετία του 70’ χρησιμοποιήθηκαν τέτοιες μέθοδοι για τη φύλαξη ωαρίων σε ασθενείς με ογκολογικές παθήσεις που υποβάλλονταν σε γοναδοτοξικές θεραπείες [1]. Γοναδοτοξική, είναι η προσέγγιση που επηρεάζει τη λειτουργία των γονάδων, δηλαδή των κυττάρων αναπαραγωγής, και περιλαμβάνει τις χημειοθεραπείες, τις ακτινοθεραπείες της πυέλου και τις ογκολογικές εγχειρήσεις κατά τις οποίες ελαττώνεται ο όγκος των ωοθηκών και των εναπομενόντων ωαρίων. Μία πιο πρόσφατη ένδειξη είναι η μετάλλαξη στο γονίδιο BRCA, η οποία συνδέεται με το καρκίνο του μαστού. Στις γυναίκες με γνωστή μετάλλαξη, συστήνεται η κρυοσυντήρηση, αφενός λόγω της σύνδεσης της με την πρόωρη γήρανση της ωοθήκης, άρα τη πρώιμη εμμηνόπαυση [2], και αφετέρου επειδή η θεραπείες που δίδονται σε περίπτωση κακοήθειας του μαστού είναι γοναδοτοξικές [3]. Το 2014, το Αμερικανικό Κολέγιο ανακοίνωσε ότι δε συστήνει τη φύλαξη ωαρίων σε υγιείς γυναίκες [4].
Κρυοσυντήρηση ωαρίων σε υγιείς γυναίκες
Η διατήρηση της γονιμότητας είναι χρήσιμη όσο ποτέ άλλοτε, κυρίως λόγω της «τάσης» για ολοένα μεγαλύτερη ηλικία τεκνοποίησης. Μελέτες δείχνουν ότι μέσα σε δύο δεκαετίες (1990-2010), ο αριθμός των γυναικών που τεκνοποιούν μετά τα 40 έτη έχει διπλασιαστεί [5]. Άλλη μελέτη κάνει τη θλιβερή διαπίστωση είναι ότι οι γυναίκες «υποεκτιμούν» την ηλικία που φθίνει η γονιμότητα κατά περίπου μια δεκαετία [6]. Με άλλα λόγια, υπολογίζουν ότι η γονιμότητα αρχίζει να μειώνεται με την εμφάνιση της κλιμακτηρίου, περί τα 45 έτη, εντούτοις, τα διαθέσιμα ωάρια, από περίπου 250.000 στην εμμηναρχή, φτάνουν τα 25.000 στην ηλικία των 37 ετών [7], συνεπώς η γονιμότητα φθίνει απότομα μετά την ηλικία των 35. Στην ηλικία των 45 ετών, το 99% των γυναικών δεν είναι γόνιμο, ακόμα και αν έχει εμμηνορρυσία [8]. Παραπέρα, η ηλικία επιδρά στα ωάρια και ποιοτικά. Το ποσοστό των ωαρίων με χρωμοσωμικές διαταραχές, ανεβαίνει απότομα μετά τα 35 έτη, κυρίως λόγω της δυσλειτουργίας της κυτταρικής ατράκτου, αυξάνοντας έτσι, τη πιθανότητα μιας πρώιμης αποβολής [9]. Η κυτταρική άτρακτος είναι ένα δίκτυο πρωτεϊνών που μετακινεί και διαιρεί τα χρωμοσώματα κατά τη κυτταροδιαίρεση.
Ως εκ τούτου, η «εξασφάλιση» της αναπαραγωγής με τεχνικές κρυοσυντήρησης, στις υγιείς γυναίκες, έχει αρχίσει να αποτελεί σημαντικό «δέλεαρ».
Ποιοι οι περιορισμοί της κρυοσυντήρησης;
Μέχρι πρόσφατα ΟΛΕΣ οι μέθοδοι κρυοσυντήρησης θεωρούνταν πειραματικές, επειδή καμία τεχνική δε κατάφερε να συντηρήσει επιτυχώς, ικανό αριθμό ωαρίων, ώστε να βελτιώσει το ποσοστό γονιμότητας σε μελλοντικό χρόνο. Βασικός ανασταλτικός παράγοντας είναι η ίδια η τεχνική της κρυοσυντήρησης, η οποία προκαλεί τη ψύξη του νερού στο εσωτερικό του κυττάρου, με αποτέλεσμα τη διόγκωση και τη λύση – δηλαδή το θάνατο – του κυττάρου. Αλλά και η απόψυξη των ωαρίων, περιλαμβάνει αυτούς τους κινδύνους, δηλαδή τη δημιουργία πάγου στο εσωτερικό του κυττάρου καθώς και τη δημιουργία κρυστάλλων (κρυσταλλοποίηση) κατά τη σταδιακή θέρμανση του [10]. Πιο συγκεκριμένα, το ποσοστό επιβίωσης των ωαρίων που κρυοσυντηρούνται, δε ξεπερνά το 10%. Ως εκ τούτου, τα αντίστοιχα ποσοστά γονιμότητας με τη χρήση τέτοιων ωαρίων είναι εξαιρετικά χαμηλά [11].
Δεν ισχύει το ίδιο για τη κρυοσυντήρηση εμβρύων, δηλαδή τη διατήρηση γονιμοποιημένων ωαρίων, που είναι υπερ-κύτταρα με εξαιρετικές ιδιότητες αντοχής και με πολύ υψηλότερα ποσοστά επιβίωσης κατά τη ψύξη (35-90%) [12]. Σε αυτή τη διαδικασία, η γυναίκα υποβάλλεται σε πρόκληση ωορρηξίας με ενέσιμα φάρμακα και τα ωοκύτταρά της, τα οποία ανακτώνται χειρουργικά, γονιμοποιούνται με σπέρμα συγκεκριμένου δότη ή από τράπεζα σπέρματος, πριν από την εκκίνηση της ψύξης [13]. Η κρυοσυντήρηση εμβρύων ευνοήθηκε τις περασμένες δεκαετίες, λόγω των μεγαλύτερων ποσοστών επιτυχίας, και μέχρι σήμερα αποτελεί τη συνήθη πρακτική διατήρησης της γονιμότητας στις γυναίκες με ιατρικές ενδείξεις. Εντούτοις, προϋποθέτει τον προσδιορισμό του βιολογικού πατέρα, «περιορίζοντας» τις κοινωνικές επιλογές της γυναίκας [13].
Τι είναι η κρυοσυντήρηση ωαρίων με υαλοποίηση (Vitrification)
Μεγάλη ελπίδα για την αύξηση του ποσοστού επιβίωσης των ωαρίων έφερε μια νεότερη τεχνική ψύξης, η υαλοποίηση (Vitrification). Η μέθοδος στοχεύει στη μείωση της κυτταρικής βλάβης από την ίδια τη ψύξη, αλλά και την επιβίωση των κυττάρων κατά την απόψυξη. Χρησιμοποιεί ένα ειδικό κρυο-προστατευτικό υγρό, το οποίο σε συνθήκες εξαιρετικά ταχείας ψύξης παγώνει το κύτταρο σε «γυάλινη κατάσταση» και εμποδίζει το σχηματισμό πάγου στο εσωτερικό του. Πρωτο-εφαρμόστηκε το 1988 σε ωάρια τρωκτικών [14] έπειτα σε κύτταρα θηλαστικών όπως προβάτων [15] και χοίρων [16], και ακόμα πιο ύστερα σε ανθρώπινα ωάρια [17]. Η υαλοποίηση δίνει κοινωνική «ευελιξία» στη γυναίκα, διότι η φύλαξη των ωαρίων, δεν προϋποθέτει την ύπαρξη βιολογικού παρτενέρ. Η διαδικασία αφορά σε ορμονική καταστολή της ωοθήκης και έπειτα τη διέγερση της, με ενέσιμη ανθρώπινη FSH (θυλακιοτρόπο ορμόνη) για 10-12 ημέρες. Η ωρίμανση των ωαρίων παρακολουθείται με τη χρήση υπερήχων. Όταν επιτευχθεί το επιθυμητό επίπεδο ωρίμανσης, χορηγείται ενέσιμη β-hCG (χοριακή γοναδοτροπίνη) και ακολουθεί η ανάκτηση των ωοκυττάρων μέσα σε 36 ώρες. Εν συνεχεία, τα ωάρια μεταφέρονται σε διάλυμα σακχαρόζης ώστε να μη δημιουργηθούν κρύσταλλοι και έπειτα ψύχονται με υγρό άζωτο στους -198oC. Τα κατεψυγμένα ωάρια μπορούν να επιβιώσουν για χρόνια. Η ίδια διαδικασία μπορεί να επαναληφθεί, ανάλογα με τον αριθμό των ωοκυττάρων που λαμβάνονται σε κάθε κύκλο. Ωστόσο, το ποσοστό επιτυχίας γονιμοποίησης αυξάνεται σημαντικά, με τη φύλαξη 15 ωαρίων και άνω [18].
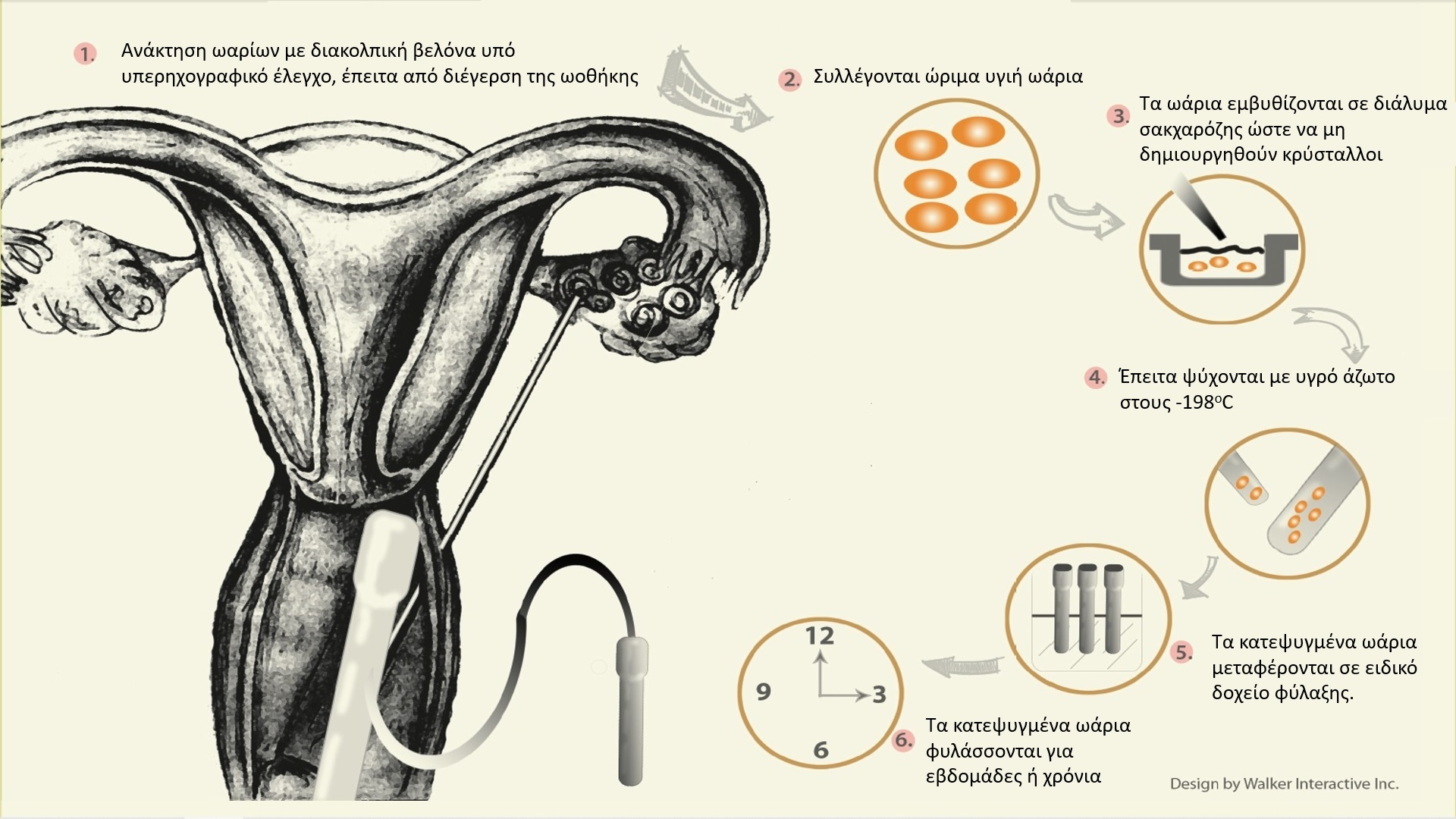
Το 2013, η Αμερικανική Εταιρεία Αναπαραγωγικής ιατρικής (ASRM) και η Αμερικανική Εταιρεία Υποβοηθούμενης Αναπαραγωγής (SART), δημοσιεύουν περί της Κρυοσυντήρησης Ώριμων Ωοκυττάρων (Mature Oocyte Cryopreservation) [19], ότι τα ποσοστά επιβίωσης των ωαρίων με τη μέθοδο της υαλοποίησης, είναι ενθαρρυντικά και προσεγγίζουν τα αντίστοιχα της κρυοσυντήρησης εμβρύων. Μάλιστα, λίγο αργότερα (το 2014), η ASRM παύει να θεωρεί την υαλοποίηση ως «πειραματική» για τη κρυοσυντήρηση ωαρίων, και πολλά κέντρα εξωσωματικής σε όλο το κόσμο σπεύδουν να την εφαρμόσουν σε υγιείς γυναίκες, ως «εξασφάλιση» της γονιμότητας σε μεγαλύτερη ηλικία.
Παρόλο που η υαλοποίηση έλυσε το πρόβλημα της επιβίωσης των ωαρίων κατά τη κρυοσυντήρηση, δεν αύξησε τα ποσοστά γονιμότητας. Πιο συγκεκριμένα, η γονιμοποίηση με κατεψυγμένα ωάρια είχε επιτυχία 47%, δηλαδή τη μισή από αυτή που είχαν τα φρέσκα ωάρια [20,21]. Σε μελέτη με 1468 γυναίκες που φύλαξαν ωάρια με υαλοποίηση, οι 137 (9%) επέστρεψαν για να τα χρησιμοποιήσουν, με ποσοστό κυήσεων 50% για τις γυναίκες ηλικίας κάτω των 35 ετών και 23% για αυτές που ήταν πάνω από τα 36 έτη [22]. Ανάλογα χαμηλά ποσοστά επιτυχίας (<22%) στις ηλικιακές ομάδες άνω των 40 ετών, διαπιστώνουν και άλλες πρόσφατες μελέτες [23]. Τέλος από την υαλοποίηση τμήματος της ωοθήκης (ιστοτεμαχίου), αντί ωαρίων, μέχρι σήμερα έχουν αναφερθεί μόλις δύο επιτυχείς γεννήσεις στην Ιαπωνία [10].Συνεπώς η υαλοποίηση αύξησε το ποσοστό επιβίωσης των ωαρίων, δίχως όμως να συνεισφέρει ουσιαστικά στη διατήρηση ή «επιμήκυνση» της γονιμότητας.
Κρυοσυντήρηση και χρωμοσωμικές ανωμαλίες
Μία από τις «απατηλές» φιλοδοξίες της κρυοσυντήρησης ωαρίων, είναι η μείωση του κινδύνου χρωμοσωμικών ανωμαλιών, δήθεν επειδή τα παγωμένα κύτταρα διατηρούνται «αναλλοίωτα» στο πέρασμα του χρόνου. Είναι γνωστό ότι ο κίνδυνος για χρωμοσωμικές ανωμαλίες, αυξάνεται με την ηλικία της μητέρας [24]. Πιο συγκεκριμένα:
- Στην ηλικία των 25 ετών, ο κίνδυνος για DOWN εκτιμάται σε 1/1350
- Στην ηλικία των 35 ετών, ο κίνδυνος για DOWN εκτιμάται σε 1/300
- Στην ηλικία των 45 ετών, ο κίνδυνος για DOWN εκτιμάται σε 1/28
Ως εκ τούτου, κάποιοι πίστεψαν ότι η ανάκτηση των κυττάρων στην ηλικία των 30-35, θα έχει μικρότερο ρίσκο χρωμοσωμικών ανωμαλιών όταν αυτά τα κύτταρα χρησιμοποιηθούν για σύλληψη σε μετέπειτα ηλικία. Δυστυχώς, αυτή η υπόθεση ΔΕΝ ισχύει, κυρίως επειδή η κρυοσυντήρηση, ακόμα και με καλό ποσοστό επιβίωσης των ωαρίων, δεν παύει τη «γήρανση» των κυττάρων, συνεπώς το συνδεόμενο με την ηλικία ρίσκο χρωμοσωμικών ανωμαλιών, που οφείλεται σε δυσλειτουργία της μειωτικής διαίρεσης κατά την ωρίμανση του ωαρίου, λαμβάνει χώρα μετά την απόψυξη του κυττάρου [3]. Παραπέρα, σε μελέτες κρυοσυντήρησης ωαρίων τρωκτικών, διαπιστώθηκε ότι η ίδια η υαλοποίηση, καταστρέφει τη κυτταρική άτρακτο, δηλαδή το δίκτυο πρωτεϊνών πάνω στο οποίο κινούνται και διαχωρίζονται τα χρωμοσώματα κατά τη κυτταροδιαίρεση [25]. Το ίδιο έδειξε πρόσφατη μελέτη με ανθρώπινα ωάρια με ποσοστό χρωμοσωμικών ανωμαλιών 49-71% ανάλογα με τη τελική θερμοκρασία απόψυξης των κυττάρων [26]. Ως εκ τούτου, η υαλοποίηση δεν μειώνει το κίνδυνο χρωμοσωμικών ανωμαλιών του ωαρίου.
Ποια είναι η κατάλληλη ηλικία φύλαξης ωαρίων
Δεν υπάρχουν σαφή κριτήρια για το ποια γυναίκα είναι κατάλληλη υποψήφια για διατήρηση ωαρίων με κρυοσυντήρηση. Η καταλληλόλητα είναι δυνατό να προσδιοριστεί από πολυάριθμους παράγοντες, όπως την ηλικία, την αξιολόγηση των δεικτών του αποθεματικού των ωοθηκών, της συγκέντρωσης της αντι-μυλλέριου ορμόνης (AMH), τις συγκεντρώσεις στο αίμα ορμονών (FSH, οιστραδιόλης) και φυσικά τη γενική υγεία της γυναίκας. Με βάση μονάχα την ηλικία της γυναίκας, η κρυοσυντήρηση:
- ΔΕ συστήνεται σε γυναίκες ηλικίας κάτω των 30 ετών, διότι δε διαπιστώνεται πρακτικό όφελος. Οι γυναίκες αυτές είτε κυοφόρησαν χωρίς τη χρήση αυτών των κυττάρων, είτε δεν κυοφόρησαν καθόλου [27]. Εξαίρεση σε αυτή την ομάδα αποτελούν οι γυναίκες με θετική μετάλλαξη στο γονίδιο BRCA [28].
- ΔΕ συστήνεται σε γυναίκες ηλικίας >38 έτη, διότι παρά την καλή ανταπόκριση σε διέγερση και ανάκτηση ωαρίων, η πιθανότητα επιτυχίας της κύησης εκτιμάται στο 22% για γυναίκες ηλικίας 41-43 ετών [28].
- ΔΕ συστήνεται σε γυναίκες >45 ετών, λόγω του χαμηλού δυναμικού ωαρίων και των εξαιρετικά χαμηλών ποσοστών επιτυχούς κρυοσυντήρησης ωαρίων [28].
- Συστήνεται σε γυναίκες ηλικίας 30-37 ετών, διότι αυτή η ομάδα έχει το μεγαλύτερο ποσοστό επιτυχούς φύλαξης αλλά και χρήσης των κυττάρων στο μέλλον. Το ποσοστό επιτυχίας κυμαίνεται στο 50-69% όταν η χρήση γίνεται κάτω των 35 ετών [28].
Συμπεράσματα για τη κρυοσυντήρηση ωαρίων
Σκοπός του άρθρου δεν είναι να αποθαρρύνει τη γυναίκα, αλλά να ξεκαθαρίσει ότι η φύλαξη ωαρίων με οποιαδήποτε μέθοδο ΔΕΝ αποτελεί εγγύηση για μελλοντική εγκυμοσύνη. Συνεπώς, η απόφαση για τη διατήρηση ωαρίων θα πρέπει να καθορίζεται έπειτα από κατάλληλη συμβουλευτική, αναφορικά με τις ενδείξεις, τις πιθανότητες επιτυχίας, τις επιπλοκές και ασφαλώς το κόστος. Τέλος, είναι σημαντικό να υπενθυμίσουμε στη γυναίκα ότι θα πρέπει να ξαναρχίσει να φαντάζεται τον εαυτό της στο ρόλο της μητέρας, σε μικρότερη ηλικία.
Βιβλίογραφία
- Hosseini, S. M., & Nasr-Esfahani, M. H. (2016). What does the cryopreserved oocyte look like? A fresh look at the characteristic oocyte features following cryopreservation. Reproductive Biomedicine Online, 32(4), 377–387. doi:10.1016/j.rbmo.2015.12.005
- Ben-Aharon I, Levi M, Margel D, et al. Premature ovarian aging in BRCA carriers: a prototype of systemic precocious aging? Oncotarget 2018; 9:15931.
- Uptodate 2021.Cryopreservation options for fertility preservation. Kutluk Oktay, Murat Sonmezer.
- ACOG: Committee Opinion No. 584: oocyte cryopreservation. Obstet Gynecol. 2014 Jan;123(1):221-222. doi: 10.1097/01.AOG.0000441355.66434.6d. PMID: 24463693.
- Matthews TJ, Hamilton BE. First births to older women continue to rise. NCHS Data Brief. 2014 May;(152):1-8. PMID: 24813228.
- Hammarberg K, Setter T, Norman RJ, Holden CA, Michelmore J, Johnson L. Knowledge about factors that influence fertility among Australians of reproductive age: a population-based survey. Fertil Steril. 2013 Feb;99(2):502-7. doi: 10.1016/j.fertnstert.2012.10.031
- Rao GD, Chian RC, Son WS, et al. Fertility preservation in women undergoing cancer treatment. Lancet 2004; 363:1829.
- Menken J, Trussell J, Larsen U. Age and infertility. Science 1986; 233:1389.
- Volarcik K, Sheean L, Goldfarb J, et al. The meiotic competence of in-vitro matured human oocytes is influenced by donor age: evidence that folliculogenesis is compromised in the reproductively aged ovary. Hum Reprod 1998; 13:154.
- Rivas Leonel EC, Lucci CM, Amorim CA. Cryopreservation of Human Ovarian Tissue: A Review. Transfus Med Hemother. 2019;46(3):173-181. doi:10.1159/000499054
- Lucas, K., & Hensel, D. (2014). Fertility preservation options for women treated for cancer. Nursing for Women’s Health, 18(2), 138–146. doi:10.1111/1751-486X.12110
- Oktay K, Cil AP, Bang H. Efficiency of oocyte cryopreservation: a meta-analysis. Fertil Steril 2006; 86:70.
- Stevenson EL, Hurt MJ, Trotter KJ. Oocyte Cryopreservation for Fertility Preservation in Healthy Women. Nurs Womens Health. 2017 Oct-Nov;21(5):384-393. doi: 10.1016/j.nwh.2017.07.004.
- Van Der Zwalmen P, Gaurois B, Ectors FJ, Touati K, Massip A, Ectors F. Some factors affecting successful vitrification of mouse blastocysts. Theriogenology. 1988 Dec;30(6):1177-83. doi: 10.1016/0093-691x(88)90293-2.
- Yoshino J, Kojima T, Shimizu M, Tomizuka T. Cryopreservation of porcine blastocysts by vitrification. Cryobiology. 1993 Aug;30(4):413-22. doi: 10.1006/cryo.1993.1041.
- Ali J, Shelton JN. Successful vitrification of day-6 sheep embryos. J Reprod Fertil. 1993 Sep;99(1):65-70. doi: 10.1530/jrf.0.0990065.
- Kasai M, Mukaida T. Cryopreservation of animal and human embryos by vitrification. Reprod Biomed Online. 2004 Aug;9(2):164-70. doi: 10.1016/s1472-6483(10)62125-6.
- Vaughan, D. A., Leung, A., Resetkova, N., Ruthazer, R., Penzias, A. S., Sakkas, D., & Alper, M. M. (2017). How many oocytes are optimal to achieve multiple live births with one stimulation cycle? The one and done approach, Fertility and Sterility, 107(2), 397–404.e3. doi:10.1016/j.fertnstert.2016.10.037
- Mature oocyte cryopreservation: a guideline. Practice Committees of American Society for Reproductive Medicine, Society for Assisted Reproductive Technology. Fertil Steril 2013;99:37–43.
- Goldman KN, Noyes NL, Knopman JM, et al. Oocyte efficiency: does live birth rate differ when analyzing cryopreserved and fresh oocytes on a per-oocyte basis? Fertil Steril 2013; 100:712.
- Kushnir VA, Barad DH, Albertini DF, et al. Outcomes of Fresh and Cryopreserved Oocyte Donation. JAMA 2015; 314:623.
- Cobo A, García-Velasco JA, Coello A, et al. Oocyte vitrification as an efficient option for elective fertility preservation. Fertil Steril 2016; 105:755.
- Cobo A, García-Velasco J, Domingo J, et al. Elective and Onco-fertility preservation: factors related to IVF outcomes. Hum Reprod 2018; 33:2222.
- Morris JK, Wald NJ, Mutton DE, Alberman E. Comparison of models of maternal age-specific risk for Down syndrome live births. Prenat Diagn. 2003 Mar;23(3):252-8. doi: 10.1002/pd.568.
- Mozdarani H, Moradi SZ. Effect of vitrification on viability and chromosome abnormalities in 8-cell mouse embryos at various storage durations. Biol Res. 2007;40(3):299-306.
- Liu M, Zhou W, Chu D, Fu L, Sha W, Liu S, Li Y. A modified vitrification method reduces spindle and chromosome abnormalities. Syst Biol Reprod Med. 2017 Jun;63(3):199-205. doi: 10.1080/19396368.2017.1285370.
- Mesen TB, Mersereau JE, Kane JB, Steiner AZ. Optimal timing for elective egg freezing. Fertil Steril 2015; 103:1551.
- UpToDate 2021. Fertility preservation for deferred childbearing for nonmedical indications.Karine Chung.
Για περισσότερες ή ειδικές πληροφορίες γράψτε στο e-mail: infobgyn@gmail.com
